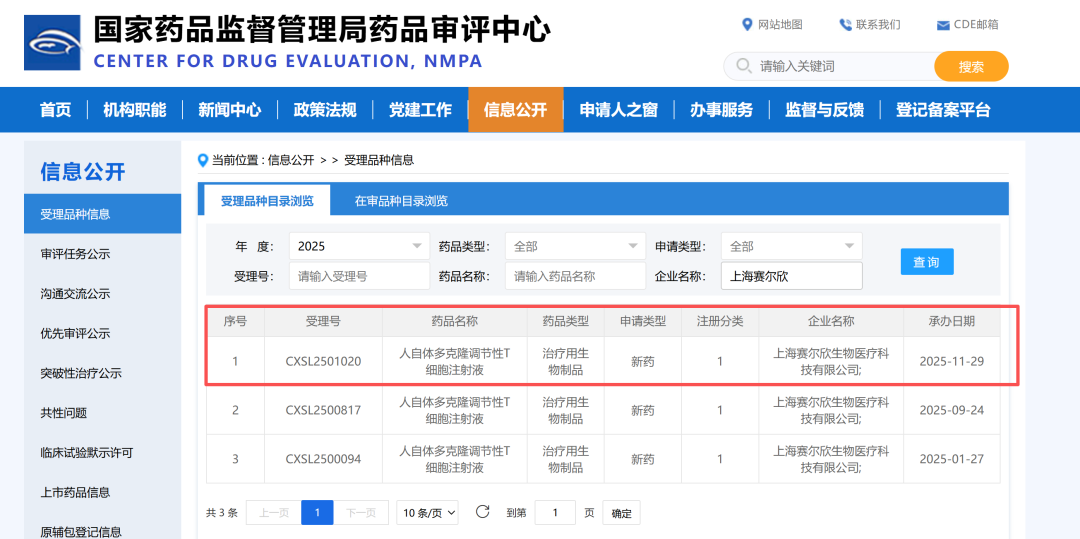
喜讯|调节性T细胞注射液(NP001项目)治疗脊髓延髓肌萎缩症(SBMA)的新药临床试验申请(IND)获国家药监局受理
2025年12月1日,上海赛尔欣生物医疗科技有限公司(以下简称“赛尔欣生物”)迎来NP001项目的新进展,其针对脊髓延髓肌萎缩症(SBMA,又称肯尼迪病)的IND已获NMPA受理。
同时,公司已向华中科技大学同济医学院附属协和医院递交一项SBMA的IIT(研究者启动的临床试验)伦理申请,计划于2026年2月正式启动,标志着该疗法从前期研究向临床阶段又迈出关键一步。
脊髓延髓肌萎缩症(Spinal Bulbar Muscular Atrophy, SBMA),俗称肯尼迪病,是一种X连锁隐性遗传的神经系统变性疾病,由雄激素受体基因第1号外显子中CAG重复序列异常扩增引起,属于多聚谷氨酰胺疾病家族。该病于2018年被列入我国《第一批罕见病目录》(序号109)。
遗传学上,SBMA主要影响成年男性,女性携带者通常不表现明显症状。发病年龄多在30~60岁,但也存在儿童期或高龄发病的罕见病例。该病具有“遗传早现”现象,即在代际传递中CAG重复次数可能进一步增加,导致子代发病更早、症状更重2-5。临床上,SBMA主要损害脑干和脊髓的运动神经元,也可累及感觉神经、骨骼肌和内分泌系统。患者常表现为进行性加重的痛性痉挛、震颤、四肢无力及延髓麻痹等症状。目前尚无能够有效延缓或阻止疾病进展的治疗方法。1
Treg细胞治疗SBMA的治疗潜力
神经炎症在SBMA的发病过程中具有重要作用。有研究显示,患者体内常出现小胶质细胞与星形胶质细胞的异常活化,伴随促炎因子如IL-6、TNF-α水平升高,进而加剧运动神经元损伤6-7。
在此背景下,调节性T细胞(Treg)展现出多方面的治疗潜力,通过多种途径调节免疫反应与组织修复:
◽在免疫调节方面,Treg通过分泌IL-10、TGF-β等抗炎因子,促进巨噬细胞由促炎性M1型向修复性M2型转化,抑制过度炎症反应。同时,Treg通过表达CTLA-4、LAG-3等抑制性受体,调控树突状细胞功能并限制效应T细胞活化。此外,Treg还可通过产生免疫抑制性腺苷及诱导炎症细胞凋亡等方式,全面抑制异常免疫应答8-12。
◽在肌肉组织修复方面,Treg通过IL-33/ST2信号轴被招募至损伤部位,进而通过分泌IL-4、IL-10、IL-13等因子,促进巨噬细胞M1向M2型极化,抑制纤维化进程。值得注意的是,Treg分泌的双调蛋白(AREG)可直接通过EGFR通路激活肌肉干细胞,促进其增殖与分化,增强组织再生能力13。
◽在不同类型的肌肉损伤中,Treg的作用机制存在差异。在急性损伤中,其聚集依赖于IL-33/ST2信号通路;而在慢性病变如杜氏肌营养不良模型中,Treg通过抑制M1型巨噬细胞活化及IFN-γ反应,减轻炎症与纤维化。研究表明,通过IL-2/抗IL-2复合物提升Treg水平可显著改善肌肉再生能力,为临床应用提供了理论依据14-15。
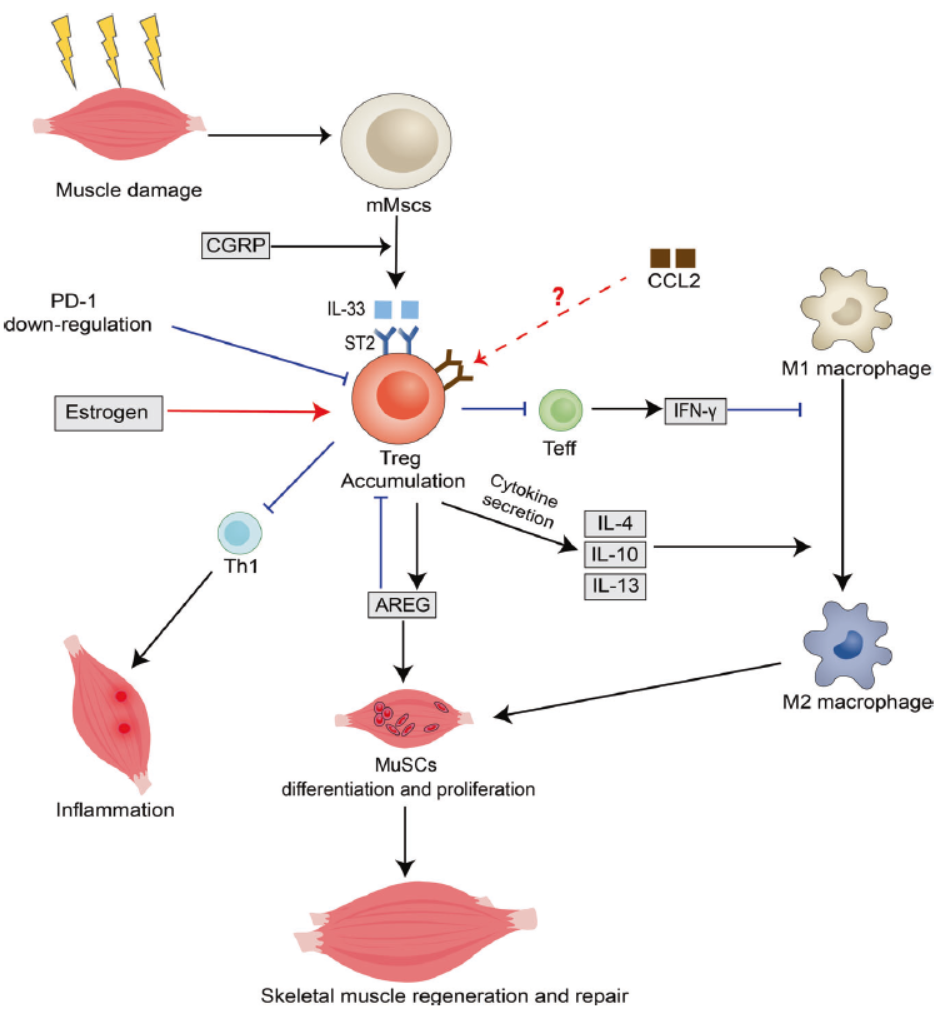
Treg肌肉组织修复作用机制
基于上述机制,赛尔欣生物开发的NP001细胞注射液旨在利用Treg疗法综合调控神经炎症、延缓疾病进展,并促进骨骼肌修复、限制肌肉纤维化。该策略不仅为SBMA的治疗开辟了新途径,也为其他神经退行性疾病的细胞治疗提供了新思路。

如需了解更多肯尼迪病相关内容,可关注【中国肯尼迪病联合会】网站,或点击链接http://cnsbma.e.zwz.hk/
文献:
-
罕见病诊疗指南(2019年版)
-
Pradat PF, Bernard E, Corcia P, Couratier P, Jublanc C, Querin G, Morélot Panzini C, Salachas F, Vial C, Wahbi K, Bede P, Desnuelle C; French Kennedy’s Disease Writing Group. The French national protocol for Kennedy's disease (SBMA): consensus diagnostic and management recommendations. Orphanet J Rare Dis. 2020 Apr 10;15(1):90. doi: 10.1186/s13023-020-01366-z. PMID: 32276665; PMCID: PMC7149864.
-
Ogata T, Muroya K, Ishii T, Suzuki Y, Nakada T, Sasagawa I. Undermasculinized genitalia in a boy with an abnormally expanded CAG repeat length in the androgen receptor gene. Clin Endocrinol. 2001;54:835–8. 38.
-
Echaniz-Laguna A, Rousso E, Anheim M, Cossée M, Tranchant C. A family with early-onset and rapidly progressive X-linked spinal and bulbar muscular atrophy. Neurology. 2005 Apr 26;64(8):1458-60. doi: 10.1212/01.WNL.0000158617.41819.F3. PMID: 15851746.
-
Atsuta N, Watanabe H, Ito M, Banno H, Suzuki K, Katsuno M, Tanaka F, Tamakoshi A, Sobue G. Natural history of spinal and bulbar muscular atrophy (SBMA): a study of 223 Japanese patients. Brain. 2006;129:1446–55.
-
Minoo Sharbafshaaer, et al. Neuroaxonal Degeneration as a Converging Mechanism in Motor Neuron Diseases (MNDs): Molecular Insights into RNA Dysregulation and Emerging Therapeutic Targets. Int J Mol Sci. 2025 Aug 7;26(15):7644.
-
https://www.ajpharm.com/news/index/2/148
-
Borsellino G, Kleinewietfeld M, Di Mitri D, et al. Expression of ectonucleotidase CD39 by Foxp3+ Treg cells: hydrolysis of extracellular ATP and immune suppression. Blood. 2007;110(4):1225-1232. doi:10.1182/blood-2006-12-064527.
-
Kobie JJ, Shah PR, Yang L, Rebhahn JA, Fowell DJ, Mosmann TR. T regulatory and primed uncommitted CD4 T cells express CD73, which suppresses effector CD4 T cells by converting 5'-adenosine monophosphate to adenosine. J Immunol. 2006;177(10):6780-6786. doi:10.4049/jimmunol.177.10.6780.
-
Huang CT, Workman CJ, Flies D, et al. Role of LAG-3 in regulatory T cells. Immunity. 2004;21(4):503-513. doi:10.1016/j.immuni.2004.08.010.
-
Yu X, Harden K, Gonzalez LC, et al. The surface protein TIGIT suppresses T cell activation by promoting the generation of mature immunoregulatory dendritic cells. Nat Immunol. 2009;10(1):48-57. doi:10.1038/ni.1674.
-
Wardell CM, MacDonald KN, Levings MK, Cook L. Cross talk between human regulatory T cells and antigen-presenting cells: Lessons for clinical applications. Eur J Immunol. 2021;51(1):27-38. doi:10.1002/eji.202048746.
-
Wu J,et al. Regulatory T cells in skeletal muscle repair and regeneration: recent insights. Cell Death Dis. 2022 Aug 5;13(8):680.
-
Hanna BS,et al. The potential for Treg-enhancing therapies in tissue, in particular skeletal muscle, regeneration. Clin Exp Immunol. 2023 Mar 16;211(2):138-148.
-
Villalta SA, et al. Regulatory T cells suppress muscle inflammation and injury in muscular dystrophy. Sci Transl Med. 2014 Oct 15;6(258):258ra142.

